【科研进展】Nat Commun | 张令强/刘翠华团队合作揭示线性泛素链组装复合物催化亚基HOIP
发布时间: 2024-04-07 09:53:14
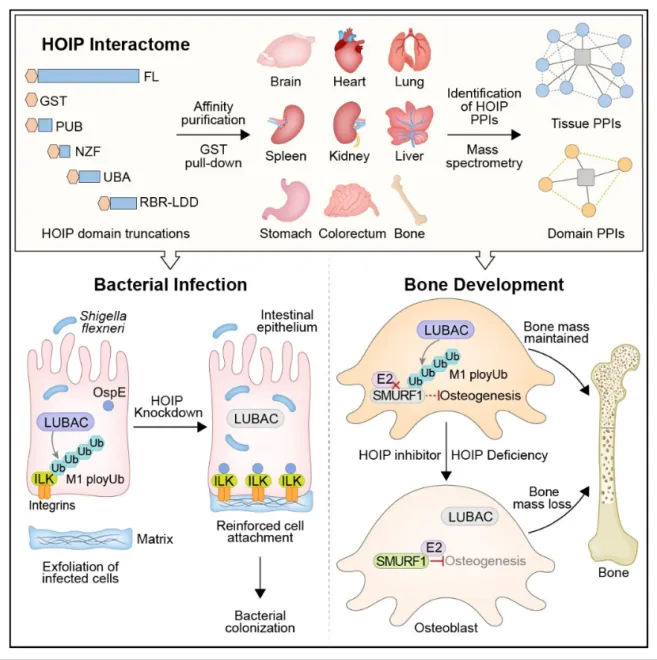
泛素化修饰作为重要的蛋白质翻译后修饰之一,与细胞周期、应激反应、信号传导和DNA损伤修复等几乎所有的生命活动密切相关【1】。泛素分子可通过7个赖氨酸残基和1个甲硫氨酸残基与其他泛素的C末端甘氨酸残基相连,形成M1、K48和K63等8种类型泛素链。其中,M1型泛素链(也叫线性泛素链)是由一个泛素的N末端甲硫氨酸残基和另一个泛素的C末端甘氨酸残基首尾共价相连的类型。线性泛素链的形成与去除过程非常特异,泛素连接酶HOIP和两个调节亚基HOIL1L、SHARPIN组成的线性泛素链组装复合物(Linear ubiquitin chain assembly complex, LUBAC)是目前发现的唯一介导线性泛素链合成的E3泛素连接酶 【2】。迄今为止,线性泛素化修饰被发现与炎症、免疫、细胞程序性坏死、血管发育等关系密切【3】。然而以往关于线性泛素化修饰的研究多集中在单种细胞或单个组织器官层面,缺少在多组织中的系统研究。
2024 年4月6日,国家蛋白质科学中心(北京)张令强团队和中科院微生物研究所刘翠华团队在Nature Communications 上发表了“Systematic HOIP Interactome Profiling Reveals Critical Roles of Linear Ubiquitination in Tissue Homeostasis”的研究长文。该研究系统构建了包含小鼠脑、心、肝、脾、肺、肾、胃、肠、骨共9 种组织器官和PUB、NZF、UBA、RBR-LDD 4种结构域的HOIP的互作网络,助力线性泛素化修饰的系统性功能与调控机制研究。

研究团队利用GST pull-down 和质谱联用的策略筛选到17078个HOIP的相互作用(平均每个组织和结构域约90个相互作用蛋白)。其中,HOIP组织层面的相互作用组加深了各个组织器官中线性泛素化修饰功能的系统认知。HOIP结构域层面的相互作用组筛选到大量潜在的线性泛素化底物并阐明生理和病理过程中HOIP结构域间的交互作用。以上研究揭示了HOIP不同结构域在多个组织中与线性泛素化修饰蛋白的结合新模式。基于互作组分析,研究团队筛选出激酶整合素连黏蛋白ILK(Integrin-linked kinase ,ILK)是线性泛素化修饰的底物,线性泛素化修饰的ILK抑制黏着斑的形成,促进志贺氏菌感染细胞的脱落。发现泛素连接酶SMURF1(SMAD-specific ubiquitination regulatory factor 1)可以被线性泛素化修饰调控。线性泛素链可破坏SMURF1与泛素聚合酶UBC12或UBCH5C的相互作用,进而抑制SMURF1对经典的骨形成调节蛋白SMAD1/5和MEKK2的降解。HOIP成骨特异性敲除小鼠也因成骨细胞中线性泛素化修饰水平下降导致SMURF1自身泛素连接酶活性释放,进而促使SMAD1/5和MEKK2的蛋白水平下降并出现骨形成能力削弱以及骨量显著下调的表型。综上,该研究系统性绘制了线性泛素链组装复合物催化亚基HOIP的不同结构域在多种组织中的蛋白互作网络图谱,进一步揭示了生理和病理过程中线性泛素化修饰的关键作用,同时也为线性泛素化修饰的深入研究提供了详实的蛋白互作网络数据参考。
国家蛋白质科学中心(北京)副研究员付业胜、助理研究员李磊、博士后张新、研究员助理邓智康、博士生吴颖为论文第一作者,国家蛋白质科学中心(北京)研究员张令强和中科院微生物研究所研究员刘翠华为论文的共同通讯作者。
原文链接
https://doi.org/10.1038/s41467-024-47289-2
泛素化修饰作为重要的蛋白质翻译后修饰之一,与细胞周期、应激反应、信号传导和DNA损伤修复等几乎所有的生命活动密切相关【1】。泛素分子可通过7个赖氨酸残基和1个甲硫氨酸残基与其他泛素的C末端甘氨酸残基相连,形成M1、K48和K63等8种类型泛素链。其中,M1型泛素链(也叫线性泛素链)是由一个泛素的N末端甲硫氨酸残基和另一个泛素的C末端甘氨酸残基首尾共价相连的类型。线性泛素链的形成与去除过程非常特异,泛素连接酶HOIP和两个调节亚基HOIL1L、SHARPIN组成的线性泛素链组装复合物(Linear ubiquitin chain assembly complex, LUBAC)是目前发现的唯一介导线性泛素链合成的E3泛素连接酶 【2】。迄今为止,线性泛素化修饰被发现与炎症、免疫、细胞程序性坏死、血管发育等关系密切【3】。然而以往关于线性泛素化修饰的研究多集中在单种细胞或单个组织器官层面,缺少在多组织中的系统研究。
2024 年4月6日,国家蛋白质科学中心(北京)张令强团队和中科院微生物研究所刘翠华团队在Nature Communications 上发表了“Systematic HOIP Interactome Profiling Reveals Critical Roles of Linear Ubiquitination in Tissue Homeostasis”的研究长文。该研究系统构建了包含小鼠脑、心、肝、脾、肺、肾、胃、肠、骨共9 种组织器官和PUB、NZF、UBA、RBR-LDD 4种结构域的HOIP的互作网络,助力线性泛素化修饰的系统性功能与调控机制研究。

研究团队利用GST pull-down 和质谱联用的策略筛选到17078个HOIP的相互作用(平均每个组织和结构域约90个相互作用蛋白)。其中,HOIP组织层面的相互作用组加深了各个组织器官中线性泛素化修饰功能的系统认知。HOIP结构域层面的相互作用组筛选到大量潜在的线性泛素化底物并阐明生理和病理过程中HOIP结构域间的交互作用。以上研究揭示了HOIP不同结构域在多个组织中与线性泛素化修饰蛋白的结合新模式。基于互作组分析,研究团队筛选出激酶整合素连黏蛋白ILK(Integrin-linked kinase ,ILK)是线性泛素化修饰的底物,线性泛素化修饰的ILK抑制黏着斑的形成,促进志贺氏菌感染细胞的脱落。发现泛素连接酶SMURF1(SMAD-specific ubiquitination regulatory factor 1)可以被线性泛素化修饰调控。线性泛素链可破坏SMURF1与泛素聚合酶UBC12或UBCH5C的相互作用,进而抑制SMURF1对经典的骨形成调节蛋白SMAD1/5和MEKK2的降解。HOIP成骨特异性敲除小鼠也因成骨细胞中线性泛素化修饰水平下降导致SMURF1自身泛素连接酶活性释放,进而促使SMAD1/5和MEKK2的蛋白水平下降并出现骨形成能力削弱以及骨量显著下调的表型。综上,该研究系统性绘制了线性泛素链组装复合物催化亚基HOIP的不同结构域在多种组织中的蛋白互作网络图谱,进一步揭示了生理和病理过程中线性泛素化修饰的关键作用,同时也为线性泛素化修饰的深入研究提供了详实的蛋白互作网络数据参考。

国家蛋白质科学中心(北京)副研究员付业胜、助理研究员李磊、博士后张新、研究员助理邓智康、博士生吴颖为论文第一作者,国家蛋白质科学中心(北京)研究员张令强和中科院微生物研究所研究员刘翠华为论文的共同通讯作者。
原文链接
https://doi.org/10.1038/s41467-024-47289-2





